Desde a antiguidade, a astronomia se desenvolveu a partir das observações feitas com nossos olhos. Atualmente, temos telescópios especializados em enxergar além do espectro visível, mas a essência é a mesma: somos totalmente dependentes da luz que chega até nós. Como não podemos simplesmente ir até uma nebulosa e coletar uma amostra do material, dependemos da radiação eletromagnética que esse corpo celeste emite e chega até a Terra para interpretar seus sinais — radiação que, muitas vezes, nem chega até a superfície devido à atmosfera.
O que cada tipo de onda no espectro quer dizer? Em que condições de temperatura e pressão são emitidas? Quais tipos de elementos químicos geram tais emissões? São todos segredos escondidos no veículo dessa informação e assunto desta matéria super ilustrada: a espectroscopia.
O espectro eletromagnético
Vamos tomar como exemplo as ondas sonoras emitidas por um piano. Temos notas agudas, de alta frequência e comprimentos de onda bem curtos; e notas graves, de baixa frequência e longos comprimentos de onda. Se formos mais além, temos também os sons que não conseguimos ouvir, como o ultrassom.

Como a luz também é uma onda, uma onda eletromagnética, podemos fazer as mesmas divisões entre curtos e longos comprimentos de onda. Essa enorme gama de frequências diferentes e com comportamentos diferentes recebe o nome de espectro eletromagnético e a emissão dessas ondas é o que chamamos de radiação eletromagnética.
Segundo a relação de Planck-Einstein, um menor comprimento de onda não significa apenas uma maior frequência, significa também que esse fóton carrega mais energia. Uma maior frequência significa maior energia, como raios X e raios gama; uma menor frequência representa uma radiação de menor energia, como ondas de rádio ou infravermelho.

Assim como temos sons que não conseguimos ouvir, as células da nossa retina (os cones e os bastonetes) conseguem captar e interpretar uma pequena parte dessas ondas eletromagnéticas que vibram em uma faixa de comprimentos de onda muito específica, entre 400 e 750 nanômetros, faixa que chamamos de luz visível.
| Banda | Frequência | Comprimento de onda |
|---|---|---|
| Rádio | Menor que 300 MHz | Maior que 1 m |
| Micro-ondas | 300 MHz – 300 GHz | 1 m até 1 mm |
| Infravermelho | 300 GHz – 430 THz | 1 mm até 700 nm |
| Luz visível | 430 – 750 THz | 700 nm até 400 nm |
| Ultravioleta | 750 THz – 300 PHz | 400 nm até 10 nm |
| Raios X | 300 PHz – 30 EHz | 10 nm até 0,01 nm |
| Raios gama | Maior que 30 EHz | Menor que 0,01 nm |
O espectro eletromagnético pode ser medido e representado de diversas formas. Podemos medir a frequência em ciclos por segundo, ou Hertz (Hz); por comprimento de onda, em metros (m); ou por energia, em elétron-volt (eV). Cada uma dessas três unidades descreve a radiação eletromagnética com altíssima precisão matemática.
As linhas de Fraunhofer
Quando a luz do Sol passa por um prisma, ela é decomposta em seus comprimentos de onda, formando um arco-íris de cores que chamamos de espectro contínuo. Isso já era percebido desde os tempos de Isaac Newton, quando ele realizou experimentos da luz do Sol passando por um prisma, mostrando que a luz branca é, na verdade, uma mistura de cores. Mas, no início do século XIX, alguns físicos prestaram bastante atenção nesse espectro do Sol e perceberam que ele não era tão contínuo assim.
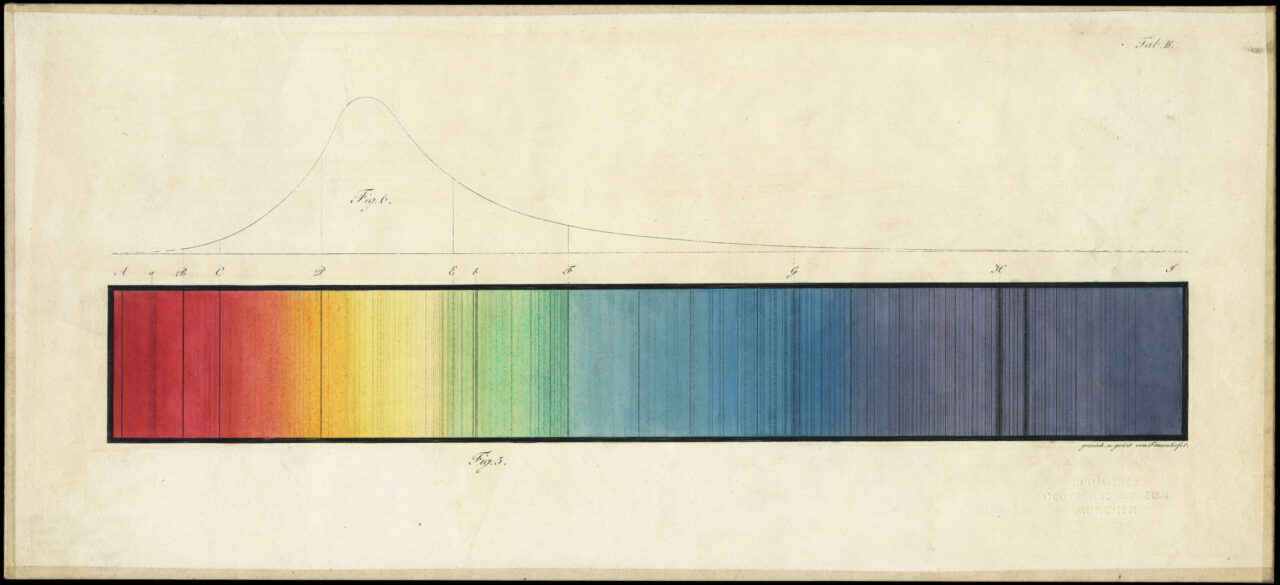
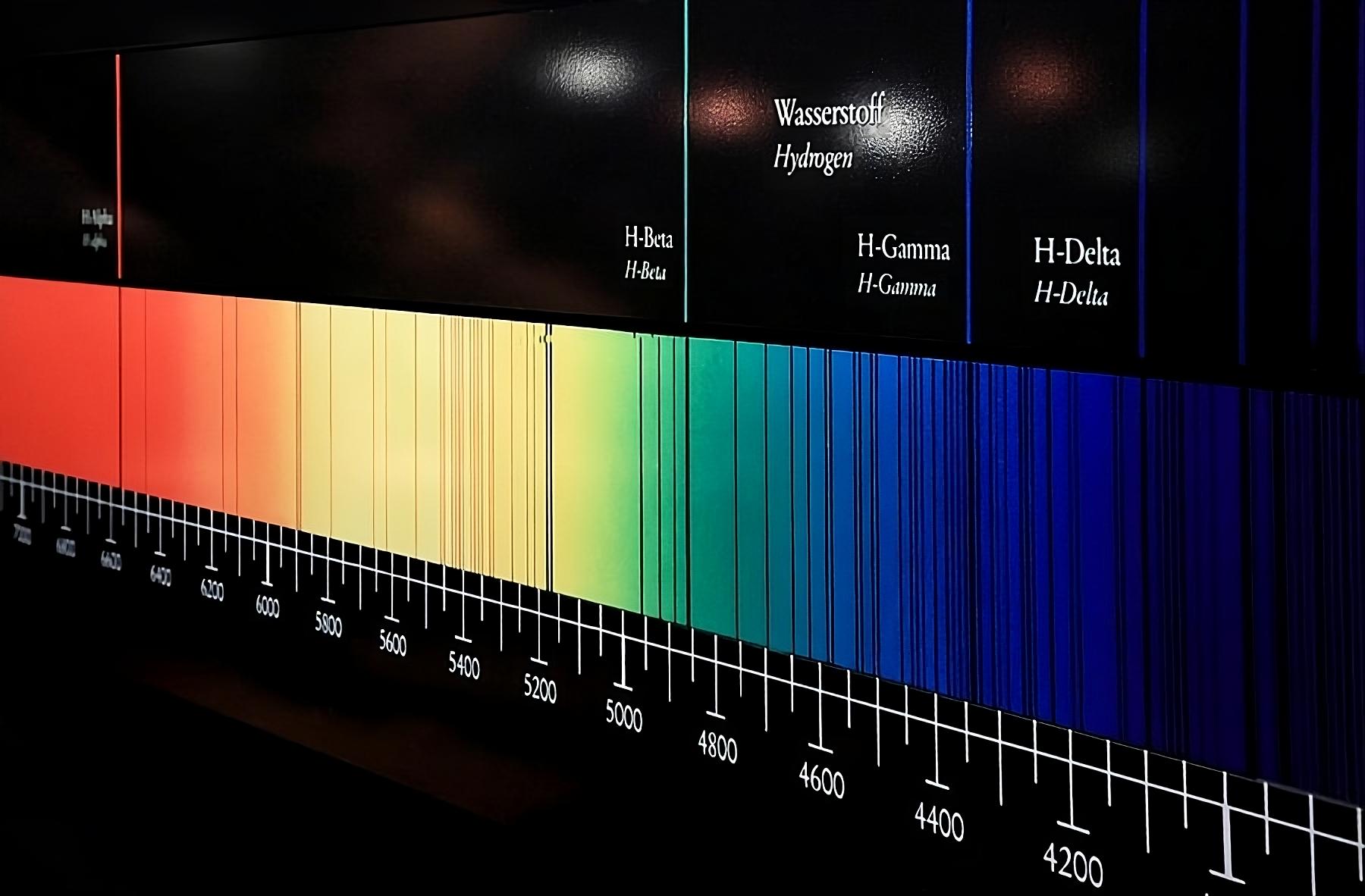
Em 1814, o físico alemão Joseph von Fraunhofer (1787–1826) percebeu que o espectro da luz solar tinha algumas linhas pretas, como se algumas cores estivessem faltando. Ele começou, então, a medir essas linhas e calcular o comprimento de onda dessas linhas, ou seja, a “cor” onde essas linhas apareciam, e atribuindo letras para identificá-las. Essas linhas ficaram conhecidas como as linhas de Fraunhofer.
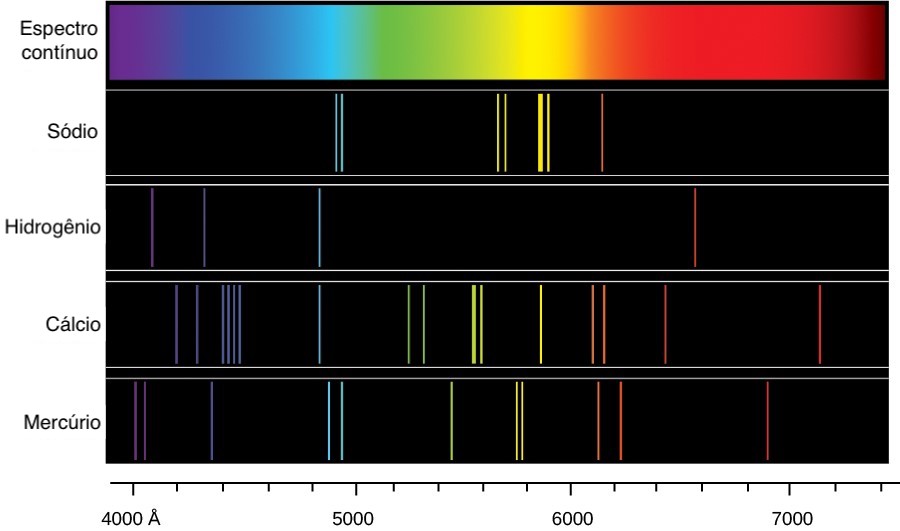
Cerca de 45 anos depois, Gustav Kirchhoff e Robert Bunsen perceberam que muitas dessas linhas coincidiam com o espectro de emissão já conhecidos de alguns elementos químicos quando eram queimados. Eles estavam corretos ao assumir que as linhas escuras do espectro do Sol eram causadas pela absorção da luz por elementos químicos na atmosfera solar — apesar de algumas das linhas serem causadas pela absorção da própria atmosfera da Terra, as linhas telúricas.
Essas observações foram aplicadas em outras estrelas, formando a classificação espectral das estrelas e levando até mesmo à descoberta de um novo elemento químico, o hélio (He). No entanto, no final do século XIX ainda faltava uma explicação plausível para o motivo da existência das linhas espectrais. Por que elementos químicos emitem e absorvem nessas linhas? Qual a razão da existência delas?
O espectro de emissão e absorção
Partiremos aos exemplos dos gases nobres. Observe abaixo, por exemplo, o espectro de emissão do neônio, um elemento muito comum em lâmpadas de letreiros luminosos. As lâmpadas de neônio (normalmente chamadas apenas de “neon”) emitem luz de cor avermelhada, pois grande parte das emissões acontecem no lado vermelho do espectro.
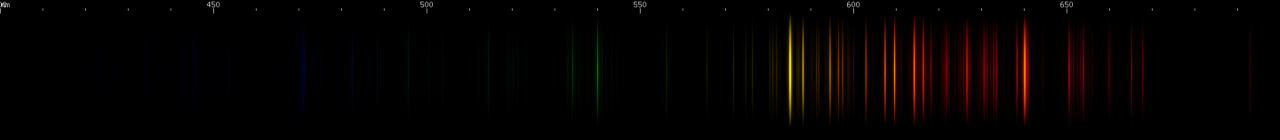
Agora, observe o espectro de emissão do xenônio. Perceba que grande parte das emissões mais intensas do xenônio acontecem na região de maior frequência do espectro, de cor azul, sendo exatamente este o motivo de as “lâmpadas de xenon” dos automóveis ser de cor azulada.
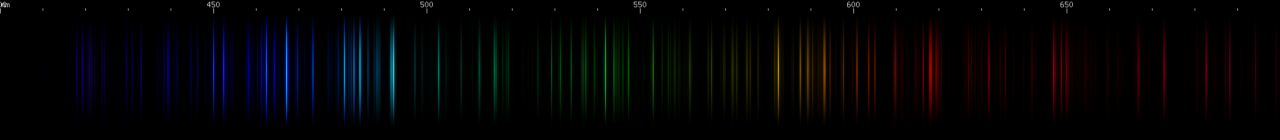
Juntos, os diferentes gases nobres emitem uma gama de cores, como podemos ver nos tubos espectrais abaixo. Cada cor é definida pelo conjunto de prótons, elétrons e orbitais que esses elétrons podem ocupar. Observe a cor dos tubos de neônio (Ne) e xenônio (Xe) e compare com as linhas espectrais vistas anteriormente.

As linhas espectrais são como se fossem as impressões digitais dos elementos químicos. A existência das linhas espectrais é explicada pela mecânica quântica em termos dos níveis de energia dos átomos e moléculas. Esses níveis de energia dependem do número de prótons, nêutrons e elétrons em um átomo e do conjunto limitado de configurações em que essas partículas podem existir.


O modelo atômico de Bohr
No modelo atômico desenvolvido por Niels Bohr, a energia de um elétron não pode assumir qualquer valor, portanto, esses elétrons devem ocupar apenas camadas específicas. Um átomo pode absorver ou emitir fótons apenas com energia correspondente à diferença de energia de uma camada eletrônica a outra.
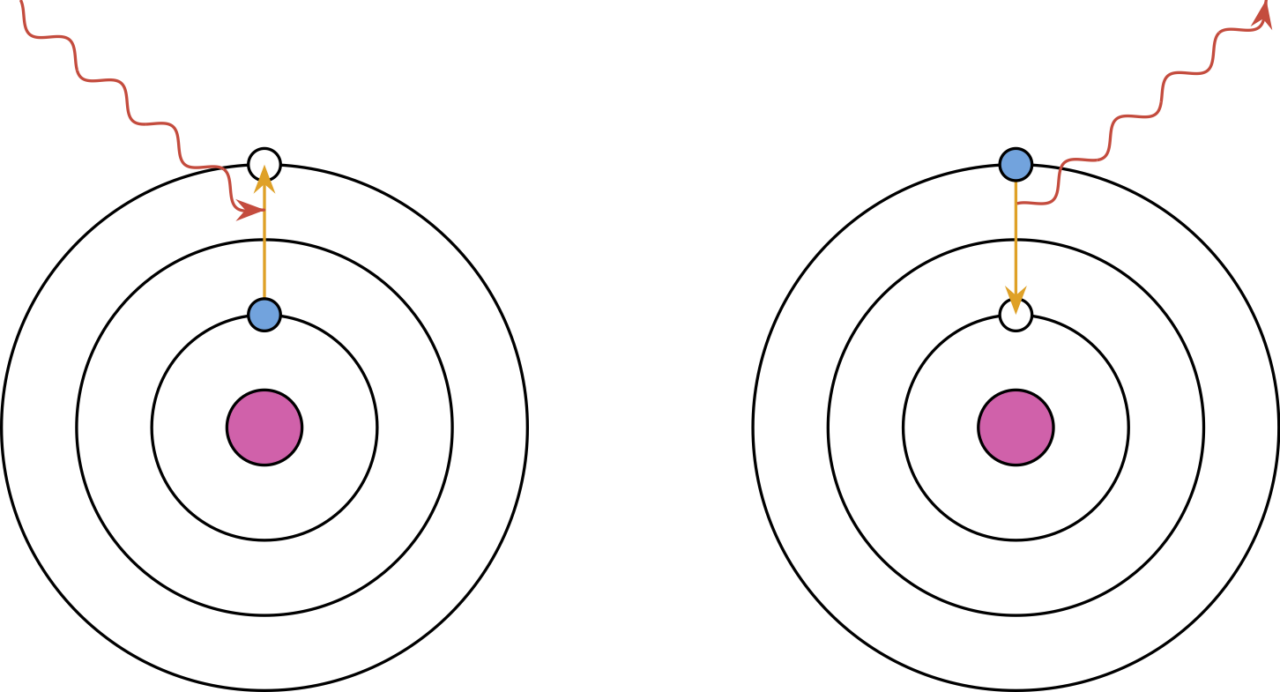
Imagine uma luz branca, com fótons de todos os comprimentos de onda, atravessando um gás neutro. Quando um fóton com energia exata para deslocar um elétron para um nível de energia mais elevado atravessa esse gás, esse fóton é absorvido, transferindo sua energia para o elétron e fazendo-o se deslocar para um nível superior — como o fóton foi absorvido, o que vemos são as linhas pretas de absorção. Quando esse elétron retorna ao seu estado fundamental, essa energia extra é reemitida na forma de um fóton — o que vemos são as linhas brilhantes de emissão.

Quanto maior a diferença de energia entre os níveis, maior a energia do fóton emitido, ou seja, mais curto é o comprimento de onda da luz emitida. Um átomo ionizado (que perdeu um ou mais elétrons) também emitirá em comprimentos de onda mais curtos, pois a maior quantidade de prótons irá “segurar” os elétrons com mais força, exigindo mais energia para elevá-los a níveis mais altos.
Pra que serve a espectroscopia?
E por que isso é importante? Porque podemos usar espectrógrafos para captar e decompor a luz de galáxias, estrelas e nebulosas e identificar seus espectros de emissão e absorção. Através deles, é possível identificar quais elementos químicos estão presentes naquele corpo celeste e quais as condições de temperatura, pressão, velocidade radial, campos magnéticos, entre outras. Essa técnica é conhecida como espectroscopia astronômica.
Hoje, quase todos os telescópios espaciais, do Hubble (com o STIS, de Space Telescope Imaging Spectrograph) ao James Webb (que tem dois, o NIRSpec, Near Infrared Spectrograph, e o MIRI, Mid-Infrared Instrument), são equipados com espectrômetros.
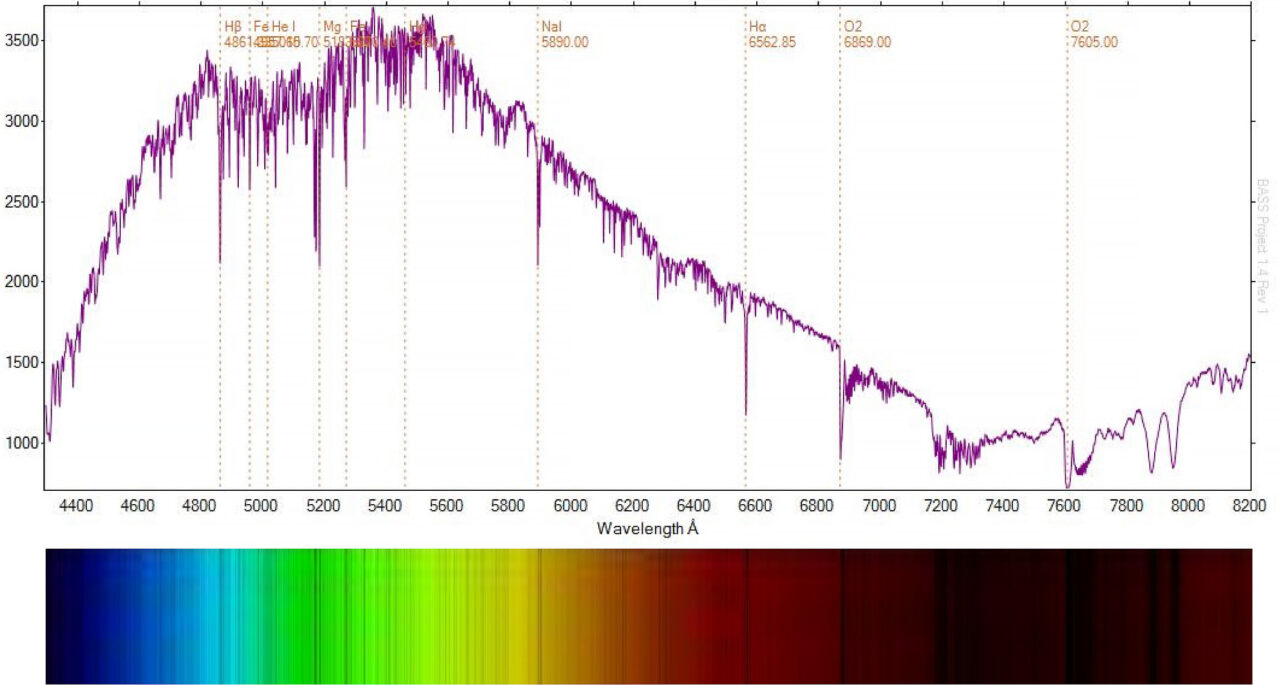
As linhas espectrais (sejam de emissão ou de absorção) de um elemento ou molécula específica sempre ocorrem nos mesmos comprimentos de onda. Essas linhas são catalogadas, portanto, ao analisar as linhas podemos identificar qual elemento ou molécula está causando essas linhas espectrais.

É dessa forma que os cientistas podem detectar a presença de atmosfera em exoplanetas e estimar sua composição, e também por isso que as lâmpadas de sódio da iluminação pública das cidades emitem luz amarela, pois o espectro de emissão do sódio é mais intenso na faixa do amarelo.
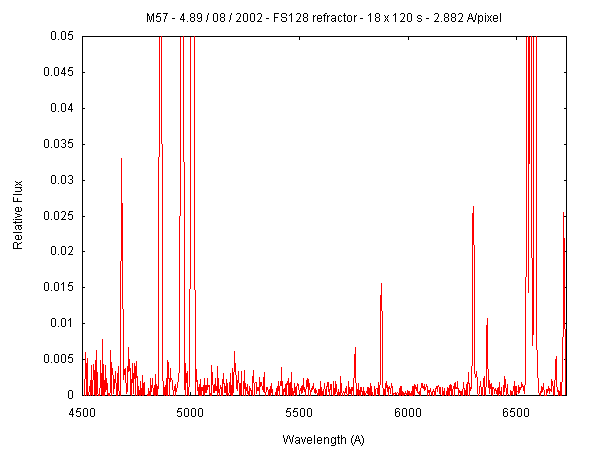
Além disso, condições variadas de temperatura e pressão alteram a presença e a largura dessas linhas. A velocidade também desloca essas linhas devido ao desvio para o vermelho (redshift). Se o hidrogênio emite uma luz vermelha de 656 nm, mas observarmos um comprimento de onda mais longo, por exemplo, 658 nm, então sabemos que esse objeto está se afastando.
Quando os pesquisadores estendem a luz de uma galáxia individual em um espectrógrafo (como o gráfico mostrado abaixo), eles podem aprender sobre a composição química, temperatura e densidade do gás ionizado dessa galáxia. Por exemplo, o espectro de uma galáxia revelará as propriedades de seu gás, o que indicará como suas estrelas estão se formando e quanta poeira ela contém.
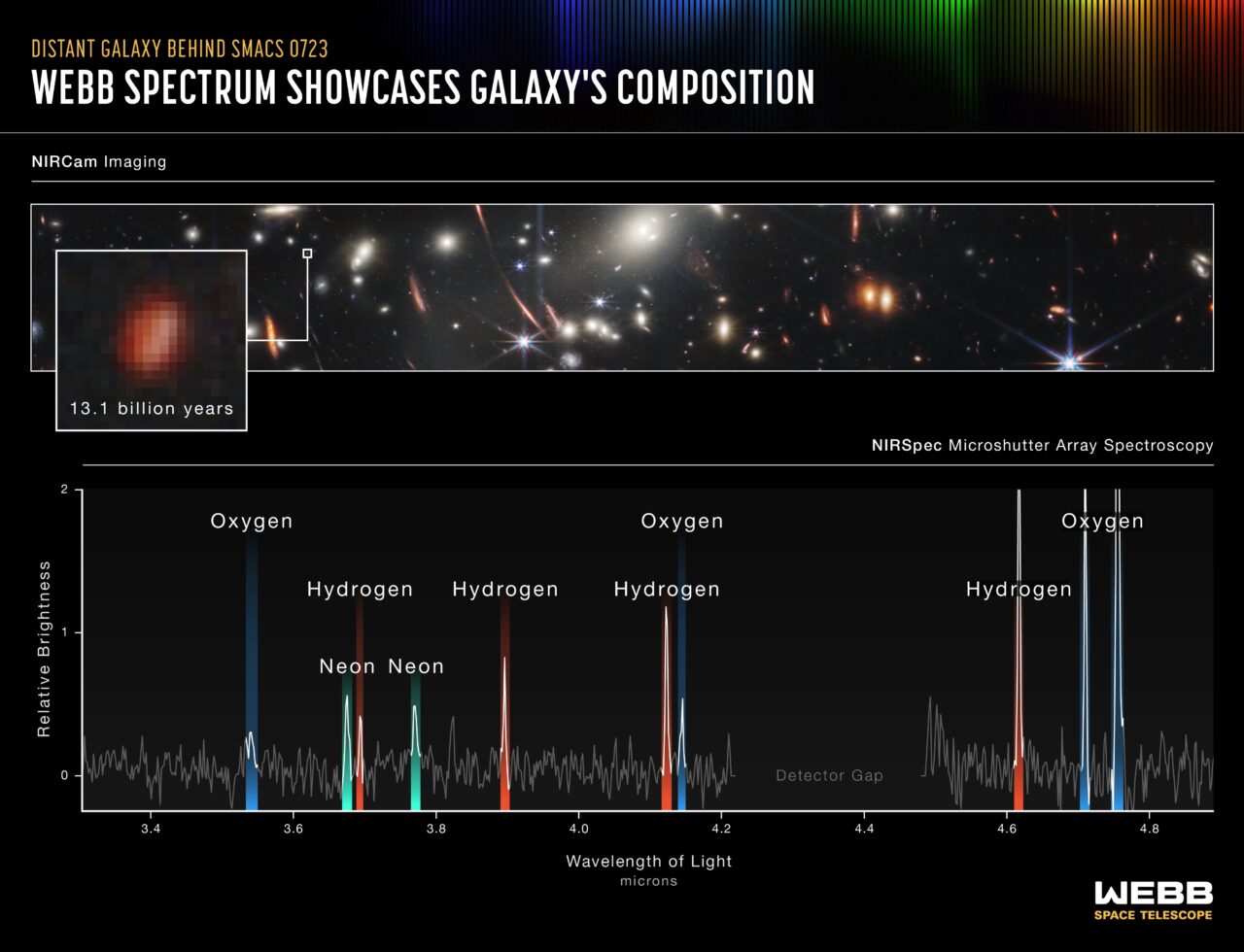
Essa técnica traz informações preciosas sobre o funcionamento do Universo, os elementos químicos que o compõem e sua abundância. Não apenas isso, os espectros são causados por níveis de energia, e a compreensão dos níveis de energia permite novos usos de materiais, como o laser de hélio-neônio, onde a energia é transferida entre os átomos para máxima eficiência e o desenvolvimento de novas tecnologias, como o LED. Prever espectros significa também ser capaz de prever as propriedades físicas e químicas de elementos que ainda não foram descobertos ou não foram produzidos em quantidade suficiente para serem experimentados.
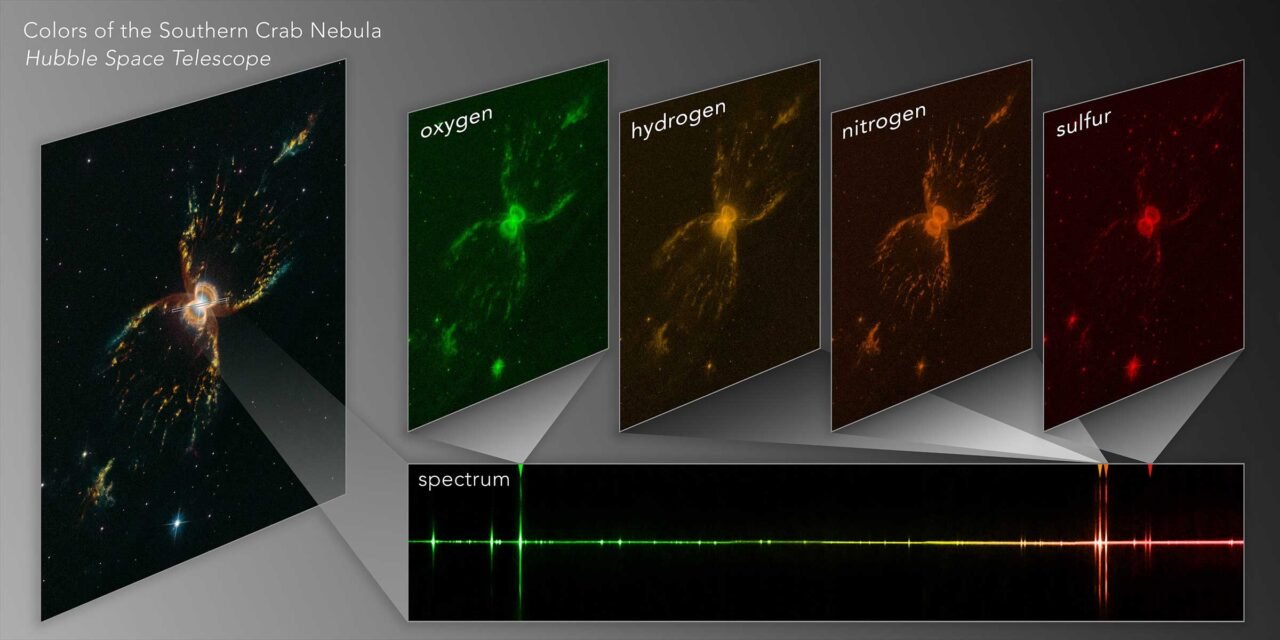
E não posso deixar de dar também um motivo muito especial: os espectros são brilhantes, coloridos e divertidos de se olhar. Tudo bem, este parece um motivo sem utilidade alguma (e enviesada, pois espectroscopia é minha área de pesquisa), mas acho que os “arco-íris fragmentados” exclusivos de cada elemento são lindos e subestimados.
Por fim, e as ondas de rádio? E os raios X?
Até aqui, mencionamos somente os espectros de transição dos elétrons. Mas temos um problema: as transições de elétrons emitem apenas infravermelho, luz visível e ultravioleta, mas não estão relacionadas às emissões de raios X ou ondas de rádio.
Essas regiões mais extremas do espectro têm origem em outros fenômenos regidos pela mecânica quântica. Então, detectar assinaturas de radiação eletromagnética nessas regiões nos permite determinar ainda mais características atômicas e moleculares de um corpo celeste.
| Transição | Energia (eV) | Banda de emissão |
|---|---|---|
| Estrutura hiperfina | 10-5 | Radiofrequência |
| Interação spin-órbita | 10-5 | Radiofrequência |
| Rotação molecular | 10-2 – 10-4 | Micro-ondas e infravermelho |
| Vibração-rotação molecular | 1 – 10-1 | Infravermelho |
| Estrutura fina atômica | 1 – 10-3 | Infravermelho |
| Transição de elétrons | 10-2 – 10 | Ultravioleta, visível e infravermelho |
| Transição nuclear | > 104 | Raios X e raios gama |
| Aniquilação elétron-pósitron | > 104 | Raios gama |