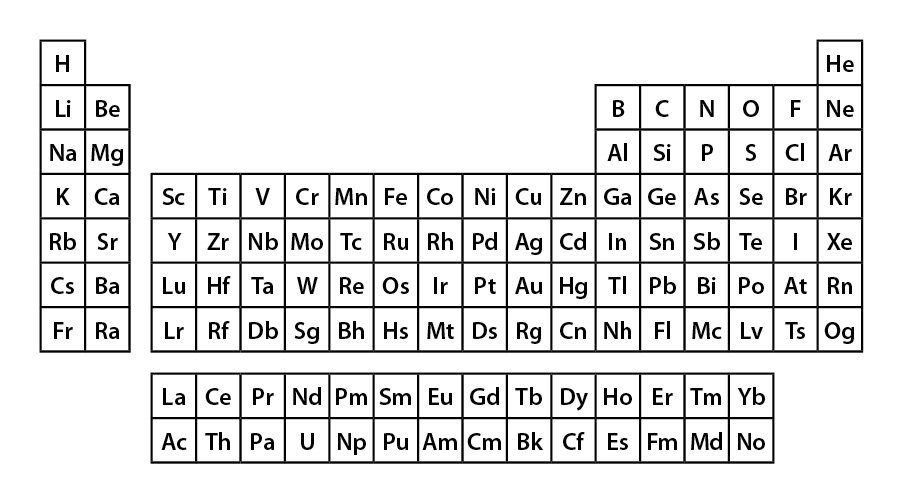
A tabela periódica é um verdadeiro ícone da química. Criada por Dmitri Mendeleev em 1869, ela organiza todos os elementos químicos conhecidos que formam todos os componentes do Universo de forma extremamente elegante: em linhas, colunas, com símbolos e agrupados por características semelhantes.
A tabela periódica é organizada em 7 linhas, chamados períodos, e em 18 colunas, os grupos. Os elementos estão em ordem crescente de número de prótons, cada coluna representa a quantidade de elétrons de valência e as linhas, a quantidade de níveis eletrônicos. Mas ela não é organizada dessa forma por coincidência ou arbitrariamente, e sim porque as características dos elementos, como reatividade e eletronegatividade, são regidos pela física atômica.
Existem elementos metálicos, gases nobres e halogênios devido às formas como os prótons, nêutrons e elétrons são arranjados no átomo. Diferentes arranjos resultam em propriedades diferentes, e os arranjos dos prótons e elétrons determinam sua posição na tabela periódica.
Vamos nos aprofundar nos detalhes dessa belíssima criação da química!
Símbolos
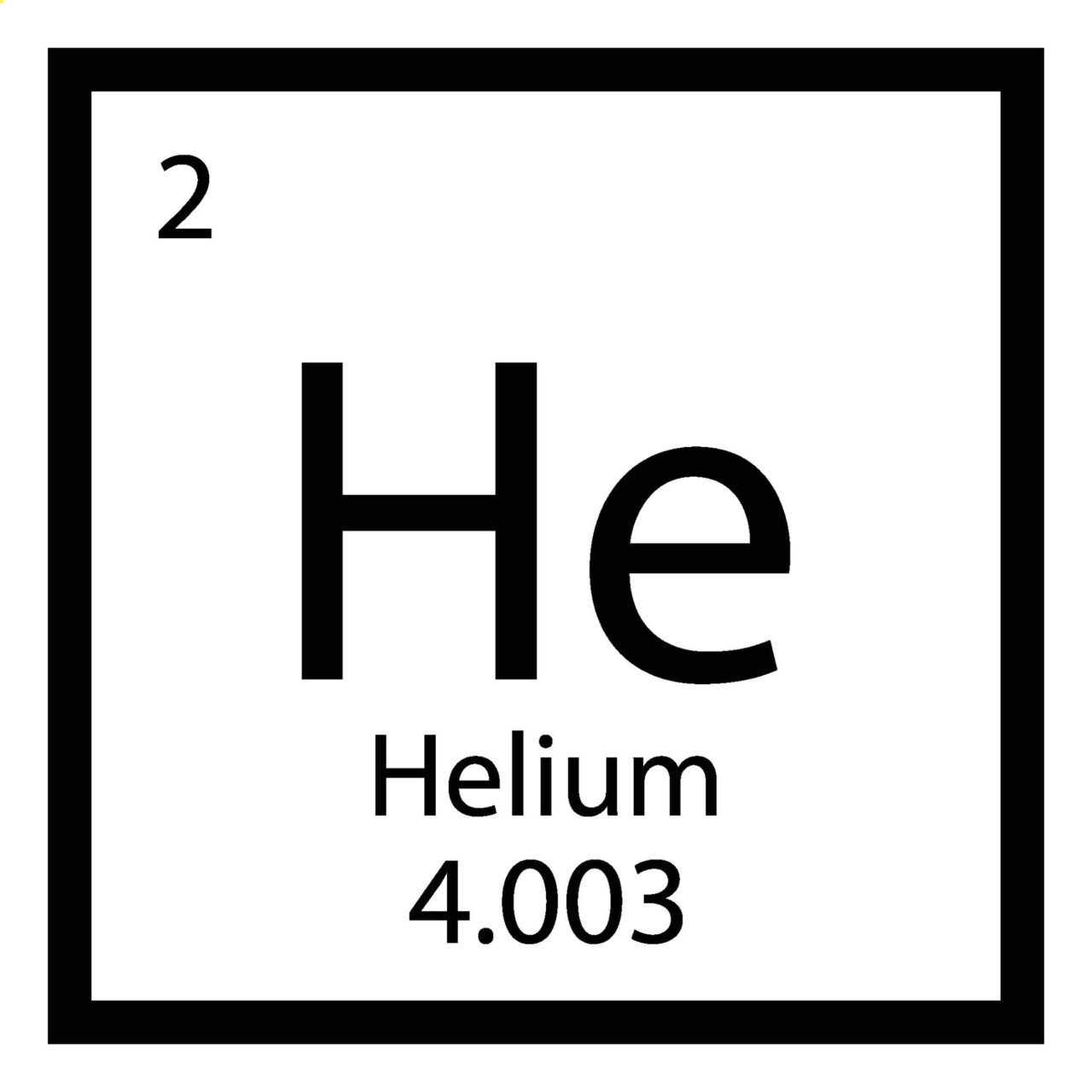
Os símbolos dos elementos químicos podem ter uma letra ou duas letras. Esses símbolos são padronizados internacionalmente para representar um elemento como uma forma de abreviar seus nomes — principalmente em longos textos ou em fórmulas. O “He” sempre será hélio, em qualquer parte do mundo.
O símbolo dos elementos normalmente vem dos seus respectivos nomes em latim ou grego. Por exemplo, o elemento Au (ouro) vem de aurum e o Pb (chumbo) vem de plumbum, ambos do latim. O elemento Hg (mercúrio) vem do grego, hydrargyrum. Alguns elementos têm outras origens, como o Mt (meitnério), dado em homenagem à Lise Meitner, a descobridora da fissão nuclear, ou W (tungstênio), que vem do alemão, Wolfram.
Curiosidade: a letra J é a única que não aparece na tabela periódica.
Número atômico
A organização fundamental da tabela periódica é o número atômico, ou seja, o número de prótons no núcleo de um átomo. Os elementos são organizados em ordem crescente de seus números atômicos, da esquerda para a direita na tabela, e da linha superior para a inferior.
Elementos químicos diferentes sempre têm números atômicos diferentes. Dessa forma, o hidrogênio (H) tem sempre 1 próton, o carbono (C) tem sempre 6 prótons e o ferro (Fe) tem sempre 26 prótons.
Importante mencionar que elementos iguais sempre têm o mesmo número de prótons, independente do número de nêutrons. O carbono sempre tem 6 prótons, mas pode ter 6 nêutrons (carbono-12), ou 8 nêutrons (carbono-14). Essas diferentes quantidades de nêutrons de um mesmo elemento formam os chamados isótopos.
O decaimento beta também pode transformar um elemento em outro. Por exemplo, o nitrogênio-13 (7 prótons + 6 nêutrons) é instável. Se um de seus prótons sofrer emissão de pósitrons (decaimento β+) e se transformar em um nêutron, o número de prótons muda e esse átomo de nitrogênio se transformará em carbono-13 (6 prótons + 7 nêutrons).
Períodos
As linhas horizontais na tabela periódica são conhecidas como períodos. Cada período corresponde ao preenchimento de uma camada eletrônica, ou nível de energia, diferente. As camadas eletrônicas são regiões ao redor do núcleo onde os elétrons têm maior probabilidade de serem encontrados.

À medida que você avança da esquerda para a direita ao longo de um período, o número atômico (que representa o número de prótons no núcleo) aumenta e mais elétrons são adicionados à camada eletrônica mais externa. Este processo continua até que a camada esteja completamente cheia de elétrons no extremo direito do período. O início de uma nova linha na tabela periódica indica a adição de elétrons a uma nova camada eletrônica.
Por exemplo, os elementos do primeiro período (como o hidrogênio e o hélio) têm seus elétrons na primeira camada eletrônica. Os elementos do segundo período, como o lítio e o neônio, têm elétrons na segunda camada. O número de elementos em cada período varia: o primeiro período tem 2 elementos; o segundo e o terceiro, 8; o quarto e o quinto, 18; e o sexto e o sétimo, 32 elementos. Isso ocorre porque o número de orbitais disponíveis para os elétrons aumenta em camadas de energia mais elevadas.
Grupos
Na tabela periódica, as colunas verticais de 1 a 18 são conhecidas como grupos ou famílias. Elementos em um mesmo grupo compartilham o mesmo número de elétrons em sua camada mais externa, conhecidos como “elétrons de valência”. Esta característica comum em sua configuração eletrônica resulta em propriedades químicas semelhantes entre os elementos do mesmo grupo.
Por exemplo, o Grupo 1 contém os metais alcalinos, como sódio e potássio, notáveis por terem um único elétron em sua camada mais externa, o que os torna extremamente reativos. Já o Grupo 2, dos metais alcalinos-terrosos, inclui elementos como cálcio e magnésio, que possuem dois elétrons de valência. O Grupo 18, dos gases nobres, inclui elementos como neônio e argônio, com camadas externas completas, tornando-os quimicamente inertes.
Os elétrons de valência dos grupos 1 e 2 ocupam o subnível s, enquanto os dos grupos 13 a 18 (exceto o hélio) ocupam o subnível p. Os metais de transição, grupos 3 a 12, têm elétrons preenchendo o subnível d e só aparecem a partir do quarto período. Este padrão reflete a ordem de preenchimento dos níveis e subníveis eletrônicos, uma organização que pode ser visualizada no diagrama de Linus Pauling.
Observe na tabela abaixo o arranjo dos níveis e subníveis eletrônicos e dos grupos com o aumento do número atômico:
| Nº atômico | Elemento | Período | Configuração eletrônica |
|---|---|---|---|
| 1 | Hidrogênio | 1 | 1s1 |
| 2 | Hélio | 1 | 1s2 |
| 3 | Lítio | 2 | 1s2 2s1 |
| 4 | Berílio | 2 | 1s2 2s2 |
| 5 | Boro | 2 | 1s2 2s2 2p1 |
| 6 | Carbono | 2 | 1s2 2s2 2p2 |
| 7 | Nitrogênio | 2 | 1s2 2s2 2p3 |
| … | |||
| 10 | Neônio | 2 | 1s2 2s2 2p6 |
| 11 | Sódio | 3 | 1s2 2s2 2p6 3s1 |
| 12 | Magnésio | 3 | 1s2 2s2 2p6 3s2 |
| 13 | Alumínio | 3 | 1s2 2s2 2p6 3s2 3p1 |
| … | |||
| 18 | Argônio | 3 | 1s2 2s2 2p6 3s2 3p6 |
| 19 | Potássio | 4 | 1s2 2s2 2p6 3s2 3p6 4s1 |
| 20 | Cálcio | 4 | 1s2 2s2 2p6 3s2 3p6 4s2 |
| 21 | Escândio | 4 | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 |
Além disso, à medida que descemos em um grupo, um novo nível eletrônico é adicionado aos átomos. Esse acréscimo de níveis e subníveis resulta em um aumento no raio atômico e uma diminuição da energia de ionização e da eletronegatividade. Por exemplo, o sódio (Na) no Grupo 1 tem um raio atômico maior e menor eletronegatividade que o lítio (Li), que está acima dele no mesmo grupo.
Os lantanídeos e actinídeos
Os elementos de transição, também conhecidos como metais de transição, ocupam uma posição intermediária na tabela periódica, localizados entre os metais à esquerda e os não-metais, halogênios e gases nobres à direita. Dentre estes, os lantanídeos e os actinídeos são grupos especiais de metais de transição caracterizados pelo preenchimento do subnível f de seus elétrons.
Observando o diagrama de Linus Pauling, que você já viu anteriormente, é possível notar que o preenchimento do subnível f começa no sexto período com os lantanídeos (subnível 4f) e continua no sétimo período com os actinídeos (subnível 5f). Esses elementos possuem propriedades únicas, como alta reatividade e, em alguns casos, radioatividade (particularmente nos actinídeos).
Os lantanídeos são conhecidos por suas habilidades magnéticas e luminescentes, sendo amplamente utilizados em diversas aplicações, como em LEDs, ímãs de neodímio e em catalisadores. Por outro lado, os actinídeos incluem elementos radioativos conhecidos, como o tório, com aplicações na engenharia de materiais, o urânio e o plutônio, essenciais para a produção de energia nuclear, e o amerício, usado em detectores de fumaça.
Esses grupos são parte da tabela periódica, mas são mostrados separadamente para evitar que a tabela fique muito grande. Este arranjo também destaca suas características e comportamentos únicos.